成果简介
目前,世界各地医院和社区中的各种细菌感染正构成严重的公共健康和环境健康风险。为解决这些问题,我们研究了一种创新的基于纳米片细菌灭活系统的“毒箭头”消毒方法,利用二维MoS2的“箭头”构型从细胞膜中有力地提取脂质并随后使膜破裂。在强氧化剂过硫酸盐(PMS)的存在下,MoS2的硫空位激活了稳定的分子,进而从边缘位置到基底区域产生活性氧物种。这一过程不仅清除了部分磷脂以实现MoS2表面的更新,同时直接攻击蛋白质,对受损细胞造成进一步损伤,增强病原微生物的受损细胞膜的压力。少量纳米片材料存在下,可实现30s内对天然水进行消毒(按细菌总数计算,灭活率为99.93%)。
引言
目前,已出现包括非均相芬顿、光电催化在内的多种高级氧化技术应用于水中细菌的灭活。自由基攻击细胞膜,改变其高分子结构,诱发通透性变化,造成细胞内必要的酶外泄,细菌由于无法完成新陈代谢、有丝分裂等生命活动而被灭活。虽然自由基能够氧化细胞膜的各种成分,但由于细胞膜的成分组成主要是磷脂、蛋白、多糖等高分子有机物,所以氧化过程需要大量自由基,这就导致了以自由基为主的消毒方式的停留时间比较长。作为典型的二维纳米材料,MoS2显著的细胞毒性来源于静电效应和硫脂之间的范德华力。由于负硫位点易与脂类中亲水头部结合,MoS2的纳米边缘可以切割细胞膜,促进膜中磷脂的提取,从而导致膜破裂和细菌细胞死亡。然而,随着纳米片表面有效活性位的迅速被占据,二维纳米材料丧失对病原微生物的灭活能力。因此,对于纳米材料物理杀菌过程,应考虑如何恢复纳米材料杀菌性能,使其保持持续杀菌能力。为了缓解自由基氧化的负荷,结合纳米材料的物理杀菌过程,我们创新提出纳米材料杀菌的理化协同机制:纳米材料对细菌的物理损伤降低了自由基氧化的负荷,同时自由基能够清洁纳米材料表面,促使纳米材料恢复物理杀菌的性能,理化过程相互促进和补充,共同实现水中致病菌的快速灭活(图1a)。
图文导读
初步比较了不同浓度的PMS的存在下MoS2纳米片的抗菌活性(图1b)。在无PMS存在下,由MoS2作用60min后,对大肠杆菌的杀菌效率约为~0.34(对数去除率)。此外,PMS具有化学氧化抑菌能力,在25℃下将E.coli和10mg/L的PMS溶液共同培养60min后,E.coli灭活率达到94%,此外,MoS2/PMS体系明显提升了E.coli灭活效率,共同培养60min后,体系中E.coli的灭活率达到>99.9986%。此外,如图1c所示,通过Alamarblue试剂盒对不同杀菌体系的新陈代谢水平评价可知,MoS2/PMS体系对E.coli的新陈代谢抑制高达97.0%,几乎彻底杀灭所有E.coli。而物理杀菌体系对E.coli新陈代谢的抑制和MoS2浓度正相关,在MoS2浓度分别为10μg/L,25μg/L和50μg/L时,新陈代谢抑制分别达到11%,24%和36%,证实了物理损伤和ROS氧化之间的协同作用可能导致优异的抗菌性能。
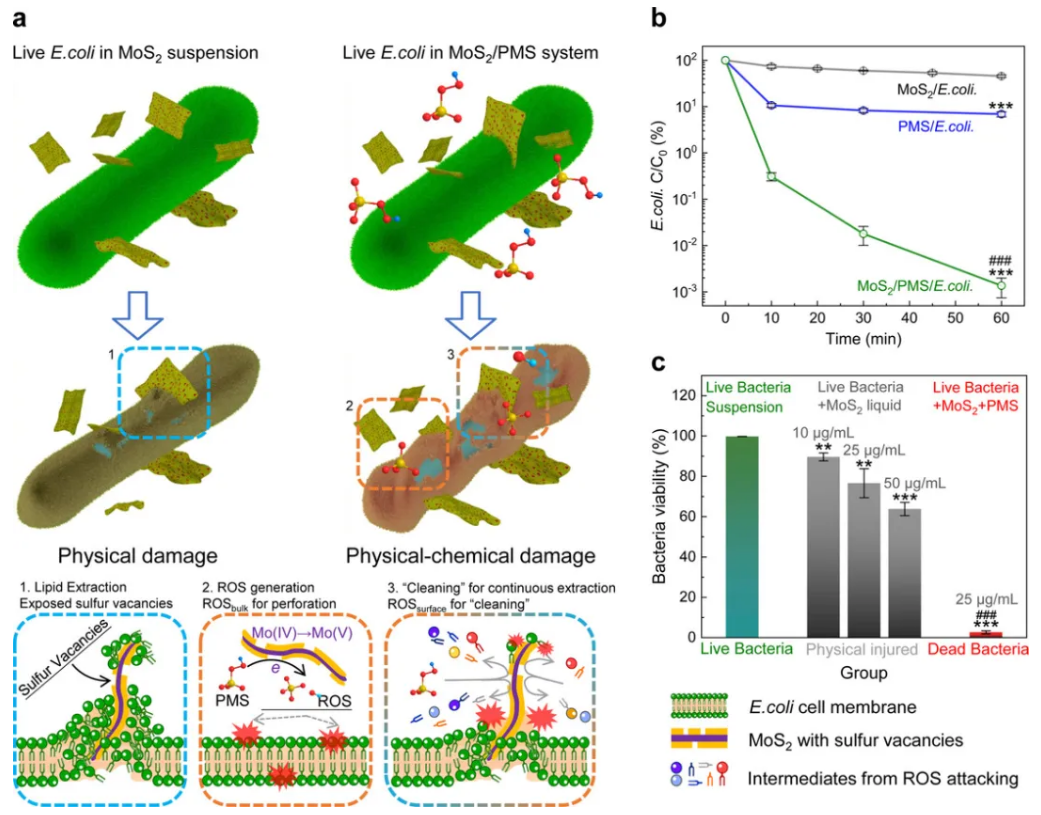
图1. a.物理-化学协同强化病原微生物灭活机制图;b-c.MoS2、PMS和MoS2/PMS系统的消毒性能和大肠杆菌活性比较
为了深入研究理化协同机制,我们首先制备了不同含硫空位的MoS2纳米片(图2a-b),并明确了MoS2纳米片对E.coli的物理损伤过程(图2c)。不同物理损伤阶段的E.coli的切片透射电镜图和扫描电镜图如图2c所示。第一阶段是鲜活的E.coli的切片,其边缘清晰,厚度约10nm,复合磷脂双分子层的理论厚度;细胞质饱满,可明显看到胶质填充满的细胞结构。随着MoS2和E.coli接触时间的延长,细胞膜的形态达到第二阶段,大量MoS2接触E.coli细胞膜,细胞膜边缘颜色变浅,部分区域的细胞膜“摊开”成一片。这一步主要发生了磷脂的抽提,MoS2在接触细胞膜后,通过静电吸引和分子间作用力将磷脂分子从细胞膜中抽提至MoS2表面,随着抽提的进行,细胞膜逐渐变薄,有些区域的磷脂和MoS2混在一起。细胞膜形态在长时间磷脂抽提后达到第三阶段,大规模长时间的磷脂抽提已经扭曲了细胞膜的原始外形,抑制了E.coli有丝分裂增殖,此外,可明显看出细胞质流失,E.coli由于缺少新陈代谢酶而最终灭活。
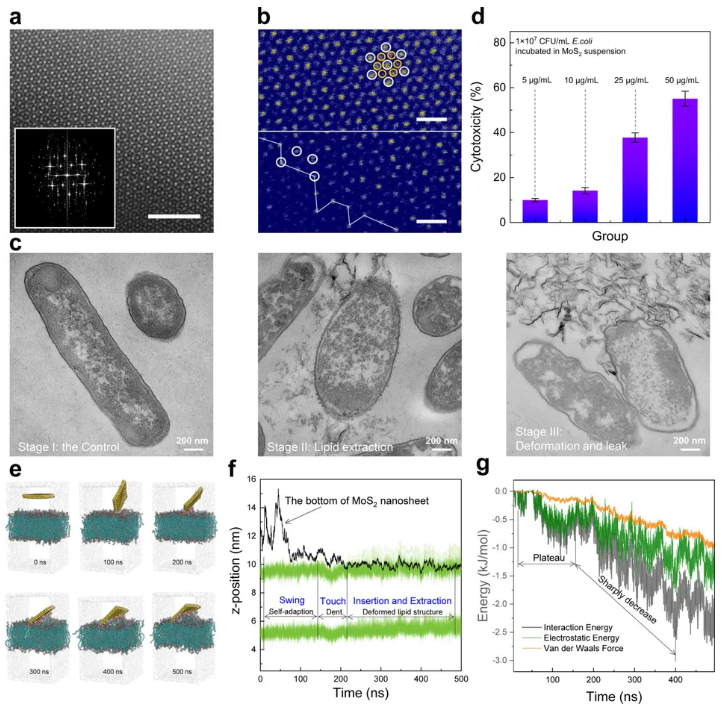
图2. a.二维MoS2纳米片的HAADF-STEM图像;b.原子水平的MoS2结构的伪色彩图像;c.MoS2条件下活大肠杆菌和死大肠杆菌的形态;d. 暴露于不同浓度MoS2悬浮液的大肠杆菌细胞释放的LDH含量;e.MoS2纳米片在300 K下从POPE脂质膜中提取脂质的过程;f.MoS2纳米片底部与脂质中的磷原子在300 K之间的z位置信息;g.细胞膜和MoS2纳米片的相互作用能随时间的演化
随后,通过分子动力学模拟能够更细致深入的揭示物理抽提过程,在建模之前,通过HPLC-HRMS准确测定了E.coli细胞膜的磷脂组成及比例。如图2e所示,磷脂组学揭示了E.coli细胞膜中的主要成分,磷脂酰乙醇胺(PE)占总磷脂的比例为83.7%,磷脂酰甘油(PG)比例为14.2%,心磷脂(CL)比例为2.12%,其余为极少量的溶血磷脂酰乙醇胺(LPE)。而在PE中,以sn1:sn2=16:0/18:1的1-棕榈酰-2-油酰-sn-甘油-3-磷酸乙醇胺(POPE)为主,如图2f所示,POPE占全体PE的比例高达21%。高分辨质谱结果为MD模拟建模提供了理论依据,在MD建模时,磷脂分子层的模型被建立为双层POPE。无缺陷的MoS2入侵细胞膜的分子动力学模拟如图2g所示,经过约100ns的自由运动到达POPE膜表面,其边缘首先和POPE分子接触,促使POPE膜发生微弱的形变,随着接触时间的延长,在静电吸引和分子间作用力的趋势下,MoS2纳米片不断变换位置,开始从磷脂层中抽离POPE分子。几百纳秒后,细胞膜上的磷脂疏水尾巴很容易铺展到整个MoS2上,导致在TEM图像中出现大量的膜皱纹。
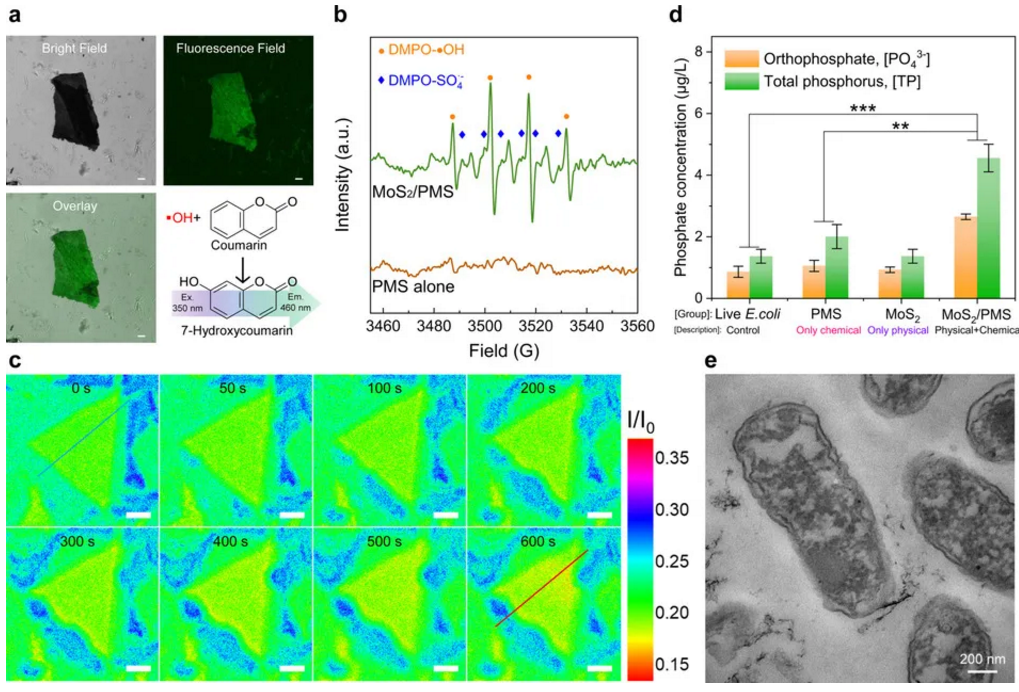
图3 a. MoS2/PMS系统中ROS生成的荧光成像;b.利用EPR光谱测定ROS;c.LSCM明长模式观察PMS激活过程中MoS2的形态变化;d.离心获得上清液或消化上清液中磷酸盐的浓度;e.MoS2/PMS系统中死大肠杆菌的形态
随着MoS2表面被磷脂分子完全覆盖,纳米片逐渐失去了对大肠杆菌造成物理损伤的能力。结合MoS2较强的活化PMS产自由基反应过程,我们提出以自由基为活性中间体去除MoS2纳米片表面负载的磷脂,以此加速病原微生物细胞凋亡。首先,采用香豆素作为探针检测PMS激活产生的ROS(图3a),发现PMS的加入可以使体系的荧光强度显著增强,证实了有效的PMS激活位点发生在基底和边缘处。随后,自旋捕捉电子顺磁共振谱的证实了MoS2/PMS体系中ROS的有效产生(图3b-c)。为了深入了解自由基氧化的作用,我们进一步研究了磷形态在灭菌过程中的演变过程(图3d)。与单一物理抽提或化学损伤相比,协同灭菌过程中磷从磷脂向水溶液的转移过程明显增强。基于此,我们提出了物理-化学协同的病原微生物灭活新机制:物理损伤抽提磷脂并减薄细胞膜,降低ROS氧化负荷;化学氧化除自身氧化细菌的细胞膜磷脂外,“清洁”已被MoS2抽提的磷脂分子,恢复MoS2抽提能力。
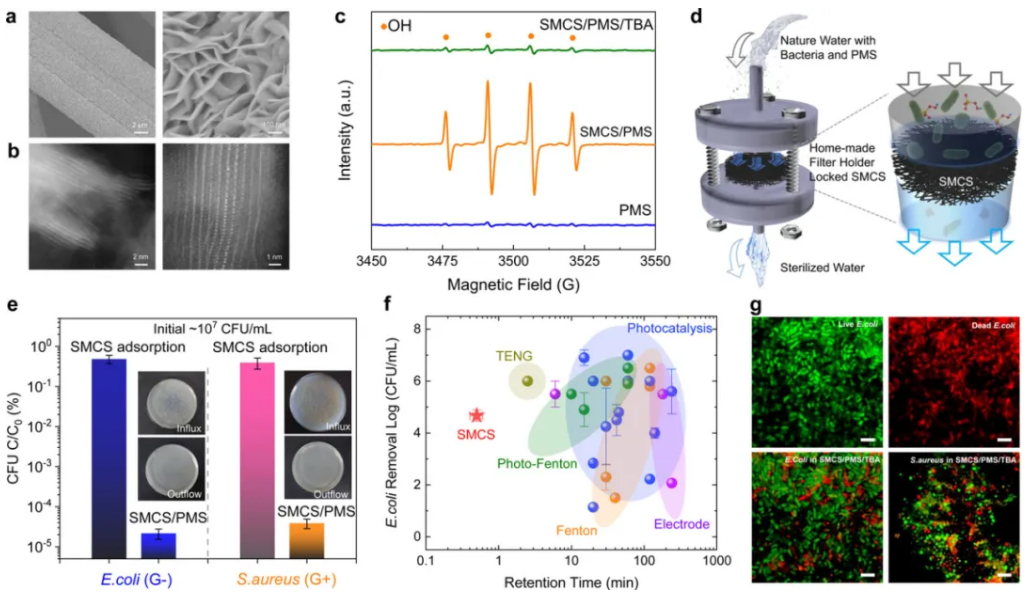
图4a. 垂直生长于碳布上MoS2的FE-SEM图像;b.MoS2尖锐边缘的HAADF-STEM图像;c.仅在PMS,SMCS/ PMS和SMCS/ PMS / TBA系统中产生ROS的EPR光谱;d.自制过滤器支架的示意图;e.SMCS的杀菌性能;f.将SMCS/ PMS系统与可比的消毒系统的杀菌性能的比较;g.活细菌和死细菌细胞的暗场荧光显微镜检查
随后,我们设计并制作了垂直生长于碳布的MoS2阵列(SMCS)。垂直生长的MoS2裸露了其锋利边缘,不仅可强化对细菌的物理损伤(图4a-b),还能保障ROS的稳定输出(图4c)。在中性条件下,PMS投加量高于100mg/L时,对细菌菌落数低于106CFU/mL的废水具有较好的消毒能力,可在不到1min内高效杀菌,其动力学高于以光电为主的各种消毒工艺。以此为核心组件,我们随后组建了针对天然水体消毒的反应器(图4d)。该处河水的总菌群数约为3×105CFU/mL,在[PMS]=100mg/L,河水总菌群去除率达99.94%。
小结
本研究通过一种新的物理化学协同机制展示了MoS2纳米片对微生物的快速灭活。主要结论如下:
(1)在PMS分子(10mg/L)存在下,带有硫空位的MoS2纳米片(10mg/ L)脱落表现出对大肠杆菌(107CFU/mL)约99.999%抗菌性能。
(2)2DMoS2纳米片中的非硫空位区(SVs-freearea)通过脂质提取破坏了大肠杆菌的膜,起到了“刀片”的作用。同时,MoS2上的硫空位区在PMS的存在下产生ROS,攻击损坏的脂膜,并清除不含硫空位的MoS2区域中负载的脂质分子,从而强化杀菌性能。MoS2中位点的这种“刷新”机制确保了对细胞膜的破坏作用的连续性,因此协同提取和氧化进一步放大了细胞膜破坏压力,并导致各种细菌的高致死率。
(3)采用该协同提取和氧化的消毒策略,可在超短时间内实现天然水的消毒,总细菌灭活率达99.94%。
主要作者介绍
陈瑀,博士毕业于中国科学院生态环境研究中心,现任清华大学水质与水生态研究中心博士后 (导师:曲久辉院士),研究方向为高级氧化水处理技术与原理。迄今,以第一作者身份在Angew. Chem.-Int. Edit.,ACS appl. Mater. Inter.等国际期刊发表SCI 3篇。
张弓,博士毕业于中国科学院生态环境研究中心,清华大学环境学院助理研究员。主要研究领域:(1)电化学水处理新技术与原理,(2)电化学污染物降解与同步产能。迄今,在Energy Environ. Sci.,J. Am. Chem. Soc.,Angew. Chem. Int. Edit.,Environ. Sci. Technol.等环境、化学权威期刊发表论文60余篇,SCI引用总计2000余次(H因子21)。获授权中国发明专利8项,国际发明专利1项;曾获中国科学院院长特别奖,入选中国科协“青年人才托举工程”。
曲久辉,环境工程专家,中国工程院院士、发展中国家科学院院士、美国国家工程院外籍院士,清华大学环境学院特聘教授,中国科学院生态环境研究中心研究员。主要从事水质科学与工程技术研究,重点关注饮用水水质风险控制、受污染水体生态修复等方面的理论探索、技术创新和工程应用。已在国内外学术期刊发表研究论文400余篇,其中SCI论文300余篇,获授权中国、美国、欧洲等中国和国际发明专利80余项,2014年当选国际水协(IWA)Distinguished Fellow。曾两次获得国家科学技术进步二等奖及国家技术发明二等奖,2009年获得何梁何利科学技术进步奖,2010年分别获得全球和东亚地区IWA创新项目奖等。






